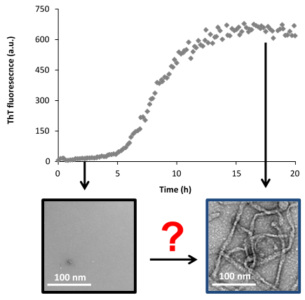
Cinétique de la formation de fibres amyloïdes suivie par la thioflavine-T et microscopie électronique à transmission
Description du projet
Les amyloses consistent en un ensemble de maladies associées aux dépôts d’agrégats protéiques insolubles, nommés fibres amyloïdes. La majorité parmi elles demeurent orphelines dû aux défis posés par le traitement, le diagnostic et par la rareté de plusieurs de ces maladies. Le point commun de ces maladies est le mauvais repliement des peptides/protéines qui s’agrègent en dépôts amyloïdes insolubles. Ces dépôts peuvent être localisés ou systémiques, au niveau de plusieurs tissus ou organes. Considérant que les espèces préfibrillaires sont hautement toxiques pour les cellules et qu’elles semblent être à l’origine de la dégénérescence tissulaire, une meilleure compréhension des évènements moléculaires précédents la formation des fibres amyloïdes permettra le développement d’essais diagnostic précoces et/ou de nouvelles approches thérapeutiques pour inhiber la formation des espèces cytotoxiques transitoires. Notre hypothèse est que les transitions conformationnelles des agrégats oligomériques vers un noyau stable jouent le rôle clé dans la base mécanistique de la formation des fibres amyloïdes et l’existence des espèces toxiques, qui forment un large ensemble conformationel. Pour cette raison nous proposons d’étudier l’effet de la perturbation de la formation d’oligomères non-structurés en favorisation une structure secondaire au niveau du monomère afin de contrôler la cinétique d’auto-assemblage amyloïde et la présence des espèces cytotoxiques.
Équipe de recherche
Nom: Margaryta Babych, M.Sc
Superviseur: Steve Bourgault (UQAM)
Lauréat: Bourse doctorat 2019