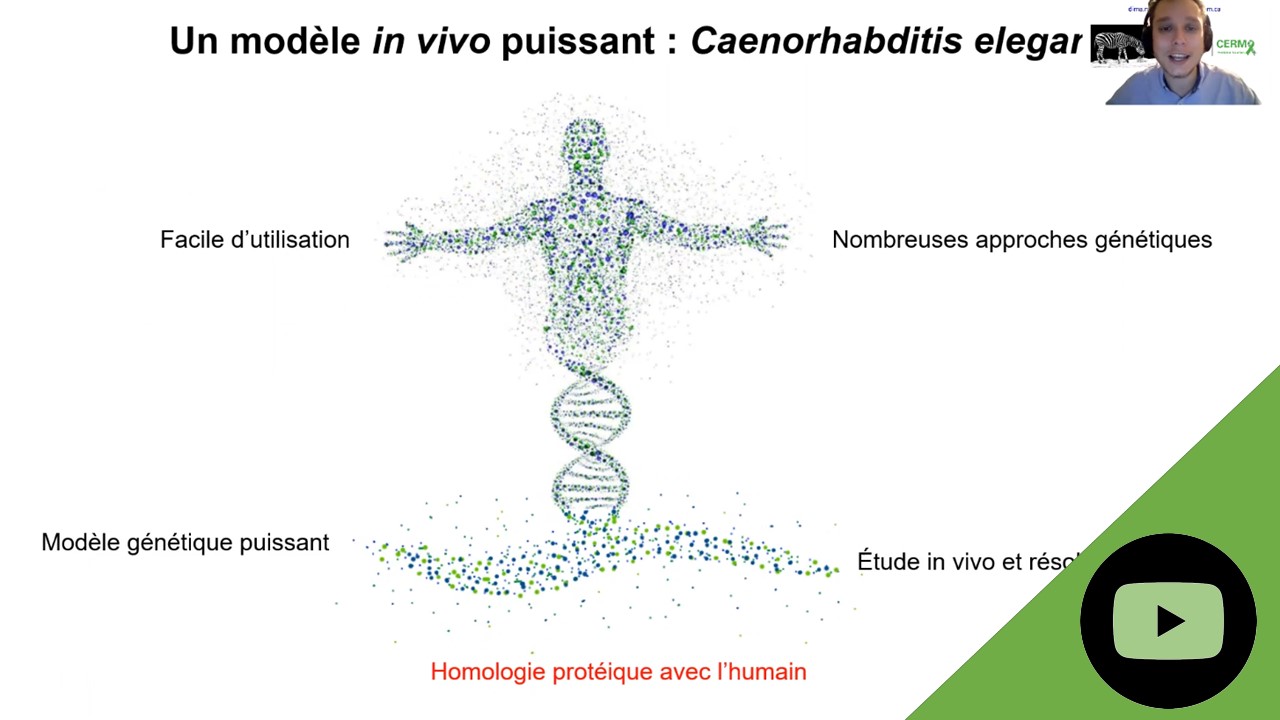
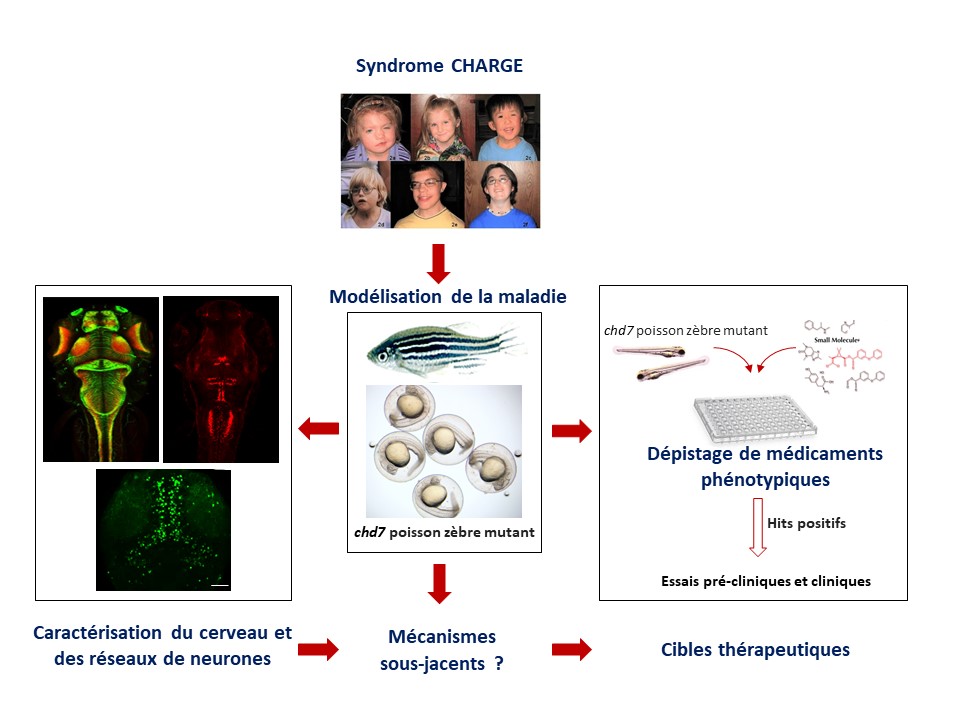
Description du projet
L’oeil embryonnaire est nourri et oxygéné par des vaisseaux foetaux transitoires appelés hyaloïdes, qui régressent après la naissance pour être remplacés par des vaisseaux sanguins rétiniens définitifs. Quand ce processus de regression des hyaloides fait défaut, on assiste à des maladies caractérisées par un développement rétinien anormal avec cécité congénitale qui représente environ 5% de la perte de vision chez l’enfant. Ces rétinopathies rares causées par la persistance des vaisseaux hyaloides à la naissance sont caractérisées par un spectre de modifications vasculaires de la rétine à la naissance qui progressent au cours de l’enfance ou de l’adolescence pour causer divers degrés de déficience visuelle. C’est le cas de la maladie de Norrie (ND), vitrée primaire hyperplastique persistant (PHPV), vitreo-rétinopathie exsudative familiale (FEVR) et la maladie de coats. Des mutations associées à ces retinopathies rares ont été identifiées dans une famille de gènes (NDP, FRZ4, LRP5, TSPAN12) qui codent pour des protéines jouant un rôle clé dans le développement vasculaire de l’oeil, de l’oreille interne et du cerveau. Ces symptômes peuvent ressembler à d’autres maladies orphelines (ex : syndrome CHARGE).
Ces maladies sont associées à un grave défaut de la vascularisation rétinienne, il est donc est impératif de comprendre le développement vasculaire au niveau de l’oeil très tôt au cours du développement embryonnaire. Le but ultime de ce programme est d’identifier les cellules embryonnaires à l’origine des vaisseaux sanguins de la rétine, ainsi que les molécules qui dirigent leur prolifération, leur migration et leur différenciation. Ces informations nous permettront de mieux comprendre et traiter les maladies oculaires rares affectant la vue d’enfants à différents âges. J’ai récemment découvert un nouveau mécanisme de sénescence prématurée (vieillissement prématuré) des cellules de la rétine dans notre modèle de souris (rétinopathie induite à l’oxygène) mimant la rétinopathie du prématuré chez l’humain. Actuellement, mes collaborateurs et moi sommes en train d’explorer une voie thérapeutique très prometteuse pour traiter cette rétinopathie rare. Notre objectif est de renverser le processus du vieillissement prématuré affectant la rétine lors de la rétinopathie du prématuré et les autres retinopathies rares.
Les stratégies de traitement actuelles incluent une photocoagulation au laser ou une ablation chirurgicale du corps vitré (vitréctomie précoce). Certes, ces interventions permettent une amélioration de la vision en arrêtant le progrès de la maladie mais la maladie persiste d’où urgence et le besoin de développer de nouvelles stratégies thérapeutiques. La découverte de nouveaux marqueurs moléculaires pour ces maladies rares aidera non seulement le diagnostic adéquat mais aussi le développement des thérapies efficaces améliorant la vue de ces patients. Ces objectifs sont en parfaite concordance avec la mission première de notre centre de recherches sur les maladies orphelines et répondent aux lignes directrice du CERMO-FC
Laboratoire de recherche
Laboratoire de la Pre Malika Oubaha (UQAM)
Lauréate: Dégrèvement d’enseignement 2019